의료기기 품질관리 심사(GMP)
의료기기 품질관리 적합인정
의료기기를 제조 또는 수입하는 업체는 의료기기법 또는 체외진단의료기기법에 따라 반드시 품질관리 적합인정(GMP)을 받은 후에 판매할 수 있습니다.
한국화학융합시험연구원(KTR)은 식품의약품안전처로부터 의료기기 품질심사기관으로 등록되어 GMP 적합 인정 업무를 수행합니다.
(품질심사업무범위) 의료기기법, 체외진단의료기기법, 의료기기산업 육성 및 혁신의료기기 지원법에 따른 품질관리체계 심사
의료기기 및 체외진단 의료기기 적용범위
- - 의료기기 제조·수입허가 또는 제조·수입인증을 받거나 제조·수입신고를하고자 하는 자
- - 임상시험용 의료기기를 제조 또는 수입하고자 하는 자
- - 적합성 인정 및 정기심사를 받고자 하는 의료기기 제조업자 또는 수입업자
- ※ 의료기기 제조 및 품질관리기준
- ※ 체외진단 의료기기 제조 및 품질관리기준
의료기기 GMP 인정업무 처리절차
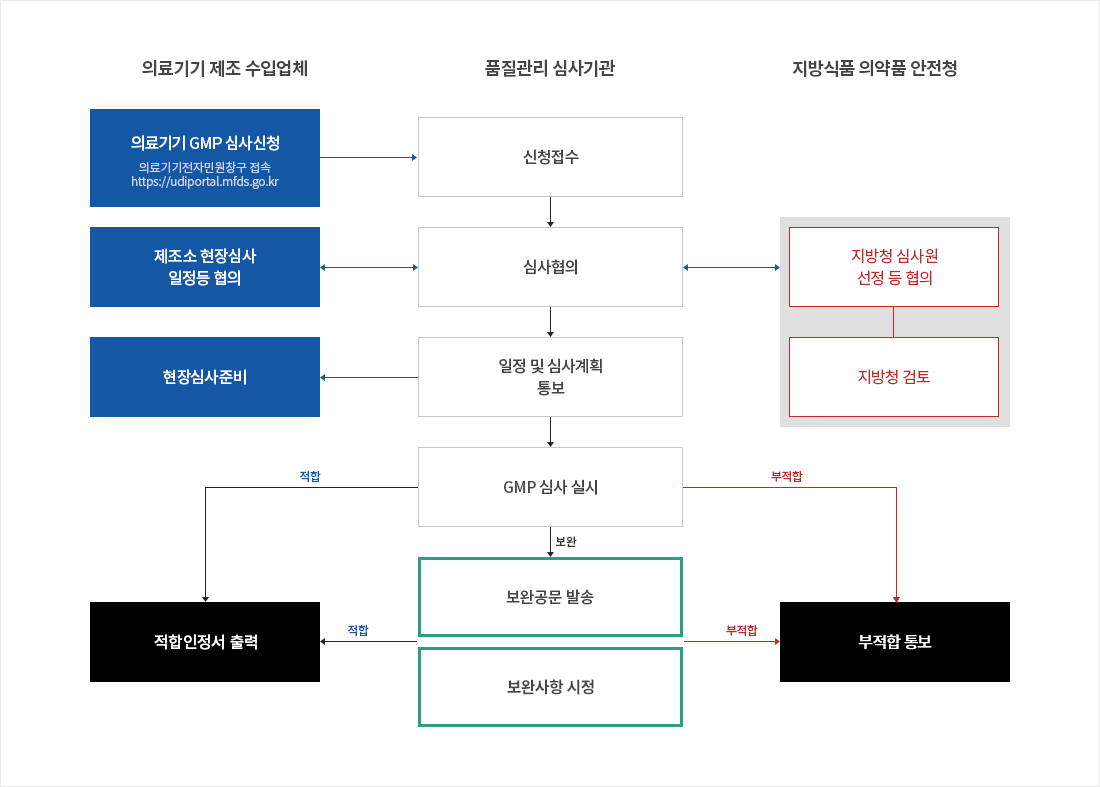
- 1. 신청접수
의료기기 제조 수입업체 → 품질관리 심사기관 : 의료기기 GMP 심사 신청 (의료기기전자민원창구 접속 https://udiportal.mfds.go.kr)
- 2. 심사협의
의료기기 제조 수입업체 ↔ 품질관리 심사기관 : 제조소 현장심사 일정등 협의
지방식품 의약품 안전청 ↔ 품질관리 심사기관 : [2등급 제외] 지방청 심사원 선정 등 협의, 지방청 검토
- 3. 일정 및 심사계획 통보
의료기기 제조 수입업체 : 현장심사 준비
- 4. GMP 심사 실시
-
5-1. 적합할 경우
- 적합인정서 출력
5-2. 보완사항이 있을 경우, 보완 공문 발송, 보완사항 지정.
- 적합할 경우 : 적합인정서 출력
- 부적합할 경우 : 부적합 통보
- - 1등급, 2등급, 3등급 및 수출용 : 단독심사 실시
- - 4등급 : 합동심사 (단, 변경·정기심사(서류검토에 한함) 와 결합심사는 단독심사 실시)
- ※ “단독”이란 품질관리심사기관(KTR)의 장이 단독으로 실시하는 적합성인정등 심사
- ※ “합동”이란 지방식품의약품안전청장(이하 “지방식약청장”이라 한다) 및 품질관리심사기관(KTR 등) 공동으로 하는 심사
GMP신청 서식 다운로드
수수료
관련규정 및 가이드라인 참고자료
의료용구의 품질관리 업무를 담당하고 있는 책임자/담당자들께서는 식양청-의료기기국 홈페이지의 자료실에 업무와 관련한 많은 자료들이 있으므로 참고하시기 바랍니다.
아래 자료들은 의료기기 품질관리 업무 수행에 필요한 자료들이므로 참고하시기 바랍니다.
참고자료
기타



